Chemia organiczna/Podstawy teoretyczne chemii organicznej/Budowa atomu
Budowa atomu[edytuj]
Atomy składają się z jądra i elektronów które krążą wokół jądra. Jądro zbudowane jest z protonów i neutronów. Atom w stanie naturalnym, ma taką samą ilość protonów i elektronów.
Jądro[edytuj]
Jądro składa się z protonów, które są naładowane dodatnio i neutronów, które nie mają w sobie ładunku. Protony i neutrony mają praktycznie identyczną masę i ich sumaryczna masa stanowi znaczną część masy atomu. Każda z tych cząstek jest zbudowana z jeszcze mniejszych cząstek, kwarków. Stosunek protonów do neutronów jest ustalony i każde odstępstwo może prowadzić do niestabilności atomu oraz do radioaktywności.
Elektrony[edytuj]
Elektrony posiadają ładunek ujemny. Masa elektrony jest ok. 2000 razy mniejsza od masy protonu czy neutronu. Elektrony poruszają się tak szybko, że nie jesteśmy w stanie stwierdzić w którym miejscu się znajdują w konkretnej chwili, możemy jedynie mówić o prawdopodobieństwie znalezienia elektronu w otoczeniu jądra.
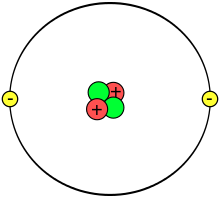
Rysunek pokazuje stary model atomu opisany przez Bohra, na którym elektrony znajdują się na abstrakcyjnym "orbitalu", co przypomina planety krążące wokół słońca. Model ten jest obecnie nieaktualny. Obecnie model atomu pokazuje "orbital" jako chmurę elektronową o specyficznym kształcie, sfery, hantla, oraz innych bardziej złożonych kształtach. Pomimo, iż model Bohra został już zastąpiony, chmurę elektronową określa się jako "orbital". Liczba elektronów i ich rozmieszczenie na poszczególnych orbitalach decyduje o właściwościach chemicznych atomów i cząsteczek.
Powłoki i orbitale[edytuj]
Orbitale elektronowe[edytuj]
Elektrony obiegają jądra w chmurach elektronowych o ściśle określonym kształcie. Chmury elektronowe są składnikiem powłoki elektronowej, w których elektrony obsadzają zawsze powłokę o najniższej energii. Elektrony znajdujące się na wyższej powłoce posiadają wyższą energię, tak samo jak skała na szczycie góry posiada większą energię potencjalną niż skała na dnie doliny. Głównym powodem obsadzania przez elektrony wyższych powłok jest to, iż na każdym orbitalu mogą znajdować się jedynie dwa elektrony. Tak więc elektrony zawsze obsadzają orbitale o najniższej energii. Elektron może zostać wypchnięty na orbital o wyższej energii np. przez foton. Zazwyczaj stan taki jest nietrwały i elektron szybko wraca na orbital o niższej energii, emitując przy tym foton. Powyższe koncepcje będą pomocne przy zrozumieniu późniejszych tematów takich jak aktywność związków chiralnych i wielu innych zjawiskowych występujących w chemii organicznej.
Natura falowa elektronu[edytuj]
Cechą elektronów jest to iż posiadają one cechy dualistyczne, polegające na tym, że w pewnych sytuacjach, zachowują się one jakby były cząstkami (korpuskułami), a w innych sytuacjach jakby były falami.
Jeśli skaczemy na skakance możemy sobie wyobrazić, że linka jest fala o określonej częstotliwości. Linia wokół której obraca się linka ze skakanki wypada w miejscu gdzie linka porusza się nieznacznie (przy uchwytach), występuje to tylko na dwóch końcach. Jeśli potrząśniemy rytmicznie linką wystarczająco szybko, używając więcej energii niż do zwykłego skakania będziesz zdolny do wytworzenia wibracji i długości fali krótszej niż podstawowa. Będziemy mogli wtedy zauważyć, że linka ma więcej niż jedno "wybrzuszenie" i wibruje ono od wyższego punktu do niższego. Dodatkowo będzie można zauważyć miejsca w których linka będzie wychylać się bardzo lekko, lub nie będzie się wychylać wcale.
Powłoki elektronowe[edytuj]
Każda powłoka składa się z jednego lub liku "orbitali", które mają różne poziomy energetyczne, aczkolwiek różnica w energii pomiędzy orbitalami jest mniejsza niż różnica energii między powłokami.
Dłuższe fale maja mniejszą energię. Orbital s posiada najdłuższe fale w elektronie będzie miał najniższą energię.
Każdy orbital posiada charakterystyczny kształt pokazujący główne miejsca występowania elektronów. Orbitale nazwane są literami alfabetu. Orbitale uszeregowane zgodnie z wzrastającą energią: s, p, d oraz f.
Wraz ze wzrostem głównej liczby kwantowej (n) opisującej powłokę elektronową możliwe jest tworzenie nowych orbitali. Powłoki są opisane liczbami całkowitymi, więc orbital 2s oznacza orbital s na drugiej powłoce.
Orbital s[edytuj]
Orbital s posiada najniższą energię. Kształtem orbitalu s jest sfera. Orbital może zostać obsadzony maksymalnie przez dwa elektrony.
Orbital p[edytuj]

Kolejnym orbitalem jest orbital p. Jego kształt jest często określany jako sztangielek. Wyróżniamy trzy orbitale p zorientowane wzdłuż osi trójwymiarowego układu współrzędnych (x, y, z). Każdy z trzech orbitali może pomieścić dwa elektrony.
Trzy orbitale p można zapisać jako px, py i pz.
Orbitale s i p są bardzo ważne w zrozumieniu większości zagadnień chemii organicznej, ponieważ te orbitale występują w atomach najczęściej występujących w chemii organicznej.
Orbitale d i f[edytuj]
Istnieją także orbitale d i f. Orbital d występuje w metalach przejściowych. Siarka i fosfor posiadają puste orbitale d. Orbitale f występują u lantanowców i aktynowców. Lantanowce i aktynowce są bardzo rzadko stosowane w chemii organicznej.
Zapełnianie powłok elektronowych[edytuj]
Kiedy atom lub jon przyjmuje elektrony na swoje orbitale, zapełniają się one w szczególny sposób.
Są trzy główne zasady obsadzania elektronów:
- Zakaz Pauliego
- Zasada rozbudowy
- Reguła Hunda
Zakaz Pauliego[edytuj]
Nie ma dwóch elektronów w atomie opisanych czterema identycznymi liczbami kwantowymi. Jest to tłumaczone tym, że każdy z dwóch elektronów zajmujących orbital ma inny spin, jeden "w górę" a drugi "w dół".
Zakaz Pauliego jest jedną z zasad mechaniki kwantowej. Został sformułowany przez Wolfganga Pauliego w 1925 roku. Mówi, że że w danym stanie kwantowym może znajdować się tylko jeden fermion. Jest to jedna z najważniejszych zasad fizyki, głównie przez to, iż opisuje własności materii, czyli protonów, elektronów i neutronów.
Zasada rozbudowy[edytuj]
Zgodnie z tą zasadą elektrony zapełniają orbitale zaczynając od tego o najniższej energii, a kończąc na tych o najwyższej (np. 1s przed 2s).
Reguła Hunda[edytuj]
Reguła ta mówi, iż najkorzystniejszym stanem energetycznym dla atomu jest posiadanie na orbitalach atomowych jak najwięcej niesparowanych elektronów.
Oktet elektronowy[edytuj]
Zaobserwowano, że oktet elektronowy, czyli osiem elektronów na zewnętrznej powłoce (walencyjnej), nadaje pierwiastkom największą trwałość upodabniając je do ósmej grupy głównej (gazów szlachetnych). Ogólnie mówiąc atomu są stabilne kiedy mają w całości wypełnioną zewnętrzną powłokę.
Powszechnym wyjątkiem tej reguły jest wodór, który na zewnętrznej powłoce posiada tylko 2 elektrony.
Inne wyjątki to glin i bor które są stabilne mając sześć elektronów na zewnętrznych powłokach, oraz kilka atomów za trzecią grupą które maja ponad osiem elektronów walencyjnych. Przykładem jest siarka. Także niektóre gazy szlachetne mogą tworzyć związki "rozszerzając" swoją powłokę walencyjną.
Orbitale molekularne[edytuj]

W chemii organicznej rozpatrujemy także hybrydyzację orbitali elektronowych zwanych orbitalami molekularnymi.

Orbitale s i p w atomie węgla ulegają wymieszaniu dając cztery hybrydy sp3 które wyglądają mniej więcej tak jak cztery balony związane razem. Węgiel przyjmuje kształt tetraedru ponieważ posiada tylko sześć własnych elektronów które wypełniają cały orbital s i tylko połowę z czterech orbitali p.
Kiedy wszystkie orbitale s i p są zapełnione atom przyjmuje kształt zwany tetraedrycznym.
