Uciążliwość zapachowa/Metody dezodoryzacji gazów/Adsorpcja
| « | Uciążliwość zapachowa Metody dezodoryzacji |
» |
| Zapachowa uciążliwość emitorów – przykłady | Metody oceny skuteczności dezodoryzacji |
Adsorpcja
[edytuj]Fizykochemiczne podstawy procesu
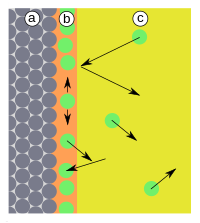
[edytuj]Adsorpcja jest rodzajem sorpcji, polegającym na zatrzymywaniu cząsteczek gazów lub cieczy na powierzchni ciał stałych (proces sorpcji przez ciecze nazywa się absorpcją). Opracowywanie teoretycznych podstaw tego procesu wchodzi w zakres chemii fizycznej[1][2][3][4].
Oddziaływanie między cząsteczkami adsorbowanymi (adsorbat) a powierzchniowymi cząsteczkami ciała stałego (adsorbent) może mieć charakter oddziaływań chemicznych (tworzenie wiązań chemicznych) albo fizycznych (oddziaływania międzycząsteczkowe, np. siły van der Waalsa). Adsorpcję chemiczną (chemisorpcję) charakteryzują stosunkowo duże efekty cieplne (ciepło reakcji chemicznych). Warstewki cząsteczek związanych z powierzchnią siłami fizycznymi (adsorpcja fizyczna) mogą być jednocząsteczkowe lub wielocząsteczkowe. Energetyczne efekty powstawania takich warstw wielocząsteczkowych są podobne do efektów sublimacji lub kondensacji par.
Najprostszym z modeli, wykorzystywanych do opisu adsorpcji jednowarstwowej, jest model Irvinga Langmuira (1916). Zgodnie z założeniami Langmuira:
- na powierzchni sorbentu znajduje się określona liczba miejsc aktywnych, na których cząsteczki adsorbatu zatrzymują się (wysycając lokalne siły wiążące),
- równowaga między adsorbatem i adsorbentem ma charakter dynamiczny; w stanie równowagi liczby cząsteczek osiadających na powierzchni i uwalnianych z tej powierzchni są jednakowe,
- w każdej chwili – bez względu na stopień pokrycia powierzchni sorbentu adsorbatem – liczba cząsteczek osiadających na powierzchni niezajętej i uwalnianych z powierzchni zajętej są proporcjonalne do odpowiednich udziałów tych powierzchni; jest to związane z założeniem braku oddziaływań między cząsteczkami znajdującymi się na powierzchni (zaniedbanie „oddziaływań bocznych”).

Zgodnie z tymi założeniami ilość adsorbatu na powierzchni sorbentu w stanie równowagi można obliczyć z równania, zwanego izotermą adsorpcji Langmuira:
gdzie:
- a – adsorpcja rzeczywista, zwykle wyrażana jako ilość adsorbatu odniesiona do jednostki masy adsorbentu,
- am – wielkość adsorpcji odpowiadająca zapełnieniu warstwy,
- K – stała równowagi adsorpcji,
- p – prężność cząstkowa gazu ulegającego adsorpcji (adsorbatu).
Oznaczając stopień pokrycia powierzchni sorbentu symbolem Θ wyraża się izotermę Langmuira jako:
lub:
co wynika z założeń:
- – stopień pokrycia powierzchni:
- – szybkość uwalniania (desorpcji):
- – szybkość osiadania (adsorpcji):
- – stan równowagi:
Zależność stanu równowagi adsorpcyjno-desorpcyjnej od temperatury jest związana za zmianami stosunku stałych szybkości obu tych procesów. Wzrost temperatury powoduje zmianę stałej K zgodnie z równaniem:
gdzie ΔE oznacza energię wiązania (wydzielane ciepło). W przypadku adsorpcji fizycznej ciepło adsorpcji wynosi zwykle kilka–kilkanaście kJ/mol, a w przypadku chemisorpcji – od kilkudziesięciu do kilkuset.



W kolejnych latach opracowano wiele innych typów izoterm adsorpcji, np.:
- izoterma Freundlicha (Boedeker, 1895; H. Freundlich, 1932)[5] – równanie empiryczne, stosowane w przypadkach sorbentów niejednorodnych, w tym mikroporowatych:
lub
lub
- izoterma BET (Brunauer, Emmett, Teller, 1938) – opisująca adsorpcję wielowarstwową; na pierwszej warstwie cząsteczek powstają kolejne warstewki, związane siłami oddziaływań adsorbat-adsorbat (energia zbliżona do ciepła skraplania). Przyjęto, że kolejne warstwy powstają analogicznie jak w modelu Langmuira, a całkowitą ilość zaadsorbowanego związku (a) można wyrazić poprzez pojemność monowarstwy (am) i udziały powierzchni sorbentu pokrytej kompleksami pojedynczymi, podwójnymi, potrójnymi itd (Θ1, Θ2, Θ3, ...)[6]:
Stałe tworzenia kolejnych warstw (kompleksów) są wyrażane jako:
- ...
gdzie symbol Θ0 oznacza ułamek powierzchni wolnej.
Dla skończonej liczby n warstw klasyczne równanie BET bywa wyrażane jako:
- gdzie:

- n – maksymalna ilość warstw tworzących się przy adsorpcji
- x = p/ps – ciśnienie względne (ps - ciśnienie pary nasyconej)
- Θ – stopień pokrycia (adsorpcja względna), który w modelu adsorpcji wielowarstwowej może być większy od jedności
- am – pojemność monowarstwy
- K – stała równowagi adsorpcji .
Stała równowagi K (często oznaczana symbolem C) jest funkcją ciepła adsorpcji w pierwszej warstwie (ΔEs) i powstawania kolejnych warstw „dwuwymiarowej cieczy”. Dla każdej z nich energia wiązania jest nieco inna, przyjęto jednak, że różnice są zaniedbywalnie małe – dla wszystkich warstewek ciekłych zastosowano taką samą wartość ΔEL[5][6]:
Model jest podstawą klasyfikacji izoterm adsorpcji, zaproponowanej przez Brunauera:
- typ I – powstawanie monowarstwy Langmuira (chemisorpcja prowadząca do stanu nasycenia),
- typ II – początkowo chemisorpcja w monowarstwie, a następnie powstawanie kolejnych warstw,
- typ III – adsorpcja wielowarstwowa od chwili początkowej (większa skłonność do kondensacji niż adsorpcji na wolnej powierzchni adsorbentu),
- typy IV i V – przypadki ograniczenia liczby powstających warstw na sorbentach o powierzchni niejednorodnej, np. wskutek zbyt małej średnicy porów (typ V – występuje najrzadziej).

Oznaczenia: a - ilość zaadsorbowanej substancji na jednostkę masy sorbentu (adsorpcja); po - ciśnienie pary nasyconej; p - ciśnienie
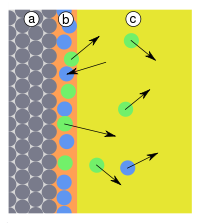
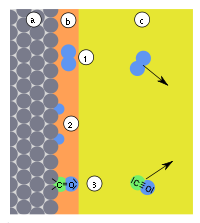
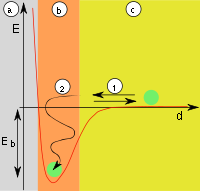
Odmienny model adsorpcji jest znany jako teoria potencjalna Polanyi'ego lub potencjałowa teoria Euckena–Polanyi’ego (Eucken, 1914; Polanyi, 1916–1922)[5]. Według Polanyi'ego warstwa zaadsorbowanej substancji ma charakter dyfuzyjny. Gęstość gazu w tej warstwie zależy od odległości od powierzchni adsorbentu, co wyrażają zmiany tzw. potencjału adsorpcyjnego. Potencjał w danym punkcie otoczenia powierzchni sorbentu jest zdefiniowany jako praca przeniesienia 1 mola adsorbatu z tego miejsca do warstwy adsorpcyjnej. Według teorii Polanyi'ego przy powierzchni znajduje się warstwa gazu, którego właściwości można opisać równaniem van der Waalsa:
gdzie:
- a – stała charakteryzująca oddziaływania między cząsteczkami gazu,
- b – stała charakteryzująca rzeczywiste rozmiary cząsteczek,
- p – ciśnienie,
- V – objętość molowa,
- n – liczba moli,
- T – temperatura bezwzględna,
- R – stała gazowa.
W najbliższym otoczeniu powierzchni gaz ma najmniejszą objętość molową (φ) i największy potencjał adsorpcyjny (Ep). Wykresy zależności potencjału adsorpcyjnego, nazwane krzywymi charakterystycznymi adsorpcji. Doświadczalne wyznaczenie zależności Ep od adsorpcji w jednej temperaturze umożliwia obliczenie izoterm adsorpcji dla innych temperatur[5][6].
Przedstawione najprostsze modele dotyczą adsorpcji jednego związku chemicznego, czystego lub występującego w gazie nie ulegającym adsorpcji. W układach rzeczywistych zanieczyszczone powietrze lub przemysłowy gaz odlotowy zawiera mieszaninę wielu zanieczyszczeń o różnych prężnościach, różnej lotności i powinowactwie do powierzchni sorbentu. Izotermy adsorpcji, wyznaczone dla pojedynczych związków, mogą być stosowane w przypadkach, gdy stopień wypełnienia powierzchni jest niewielki (każdy ze związków jest adsorbowany niezależnie od pozostałych). Sytuacja jest bardziej skomplikowana w przypadkach dużego nasycenia powierzchni (zob. np. izoterma Everetta dla mieszanin dwuskładnikowych). W czasie ustalania się równowagi ciecz-gaz zachodzą wówczas procesy adsorpcji wymiennej (konkurencyjnej). Charakterystycznym przykładem adsorpcji konkurencyjnej są procesy adsorpcji węglowodorów i innych związków o małej polarności na powierzchni węgla aktywnego, zachodzące w obecności pary wodnej (np. wilgotność względna powietrza przekraczająca 65% znacząco skraca czas ochronnego działania filtrów masek gazowych[7]). Trzeba też brać pod uwagę możliwość zachodzenia w warstwie zaadsorbowanej reakcji chemicznych, prowadzących do uwalniania do fazy gazowej lotnych produktów (nieobecnych w gazach wprowadzanych do adsorbera).
W czasie badań dynamiki adsorpcji gazów na testowanych adsorbentach wykonuje się oznaczenia stężenia zanieczyszczeń w strumieniu wypływającym ze złoża o określonej grubości. Pomiary czasu przebicia złoża (tD) i czasu nasycenia (ts) pozwalają określić szybkość przesuwania się czoła warstwy adsorpcyjnej (w) i grubość tej warstwy (L).
Adsorbenty
[edytuj]
Charakterystyczną cechą różnych rodzajów adsorbentów jest ich powierzchnia właściwa, czyli wielkość powierzchni odniesiona do jednostki masy, ściśle związana z porowatością materiału. Powierzchnia właściwa materiałów nieporowatych, np. otrzymywanych metodami mielenia lub krystalizacji soli (osady drobnokrystaliczne), wynosi zwykle 0,1–10 m²/g (najczęściej ok. 1 m²/g). Znaczenie techniczne mają sorbenty porowate (węgle aktywne, silikażele, aluminożele, sita molekularne), których powierzchnia właściwa osiąga wartości rzędu 10²–10³ m²/g[8].
Węgiel aktywny otrzymuje się w wyniku karbonizacji, polegającej na ogrzewaniu naturalnych sproszkowanych materiałów organicznych, np. węgla drzewnego, kości, łupin orzechów, pestek, z których odpędzane są związki lotne. Produkt ma strukturę porowatą, zwykle o powierzchni właściwej 400–900 m²/g. Aktywność otrzymywanego sorbentu zwiększa się wprowadzając do materiału organicznego przed karbonizacją dodatki chemiczne, np. chlorki metali (aktywacja chemiczna), lub poddając produkty karbonizacji]] działaniu reagentów gazowych, np. pary wodnej i dwutlenek węgla (czasami tlenu, powietrza lub Cl2, SO2, par siarki). Otrzymywane aorbenty klasyfikuje się na podstawie łącznej objętości i rozkładu średnic porów – udziału mikroporów o d < 1nm), mezoporów (d = 2–50 nm) i makroporów (d > 50nm). Objętość porów zawartych w 1 gramie węgla aktywnego wynosi ok. 1–1,4 cm³/g (w 1 g aktywnego koksu – ok. 0,3 cm³/g).
Węgiel aktywny słabo adsorbuje takie zanieczyszczenia powietrza i gazów przemysłowych, jak np. HCN, H2S, SO2 lub NOx. Do ich usuwania stosuje się tzw. „sorbenty węglowe”. Ich otrzymywanie polega na impregnowaniu węgla aktywnego o dużej zawartości makroporów reagentami chemicznymi (np. sole lub tlenki metali, jod, siarka). Tak otrzymane sorbenty, stosowane m.in. w pochłaniaczach osobistej ochrony dróg oddechowych, to np.[9][7][10]:
- sorbent SDH-3, zawierający węglan sodowy i potasowy, stosowany w pochłaniaczach gazów kwaśnych, np.:
- Na2CO3 + H2S → Na2S + H2O + CO2
- sorbent SPA-1, zawierający siarczan cynkowy, stosowany w pochłaniaczach amoniaku:
- ZnSO4 + 4 NH3 → [Zn(NH3)4] SO4
- sorbenty jodowane GIG i carbojodum, stosowany w pochłaniaczach par rtęci,
- sorbenty uniwersalne typu actipol, impregnowane tlenkami miedzi, chromu i srebra, stosowany w pochłaniaczach par związków organicznych i gazów ulegających reakcjom katalitycznym, np.:
- 2 PH3 + 3 O2 (+ kat.) → P2O3 + 3 H2O
- CuO + SO2 → CuSO4
Zużyty węgiel aktywny może być regenerowany parą; sorbenty węglowe po regeneracji muszą być ponownie impregnowane reagentami chemicznymi.
Działanie sorpcyjne silikażeli, aluminożeli i zeolitycznych sit molekularnych przypomina proces absorpcji − polega na wnikaniu cząsteczek zanieczyszczeń do luk międzywęzłowych w sieciach krystalicznych sorbentów, np. otrzymywanych przez usunięcie wody krystalizacyjnej z glinokrzemianów sodu lub wapnia. Sita typu A mają sieć krystaliczną regularna prosta, a sita X – sieć typu diamentu. W sieciach występują elementarne tetraedry SiO4- i AlO4-. Sita 4A mają efektywną średnicę porów ok. 4 angstremy (Å), a sita 5A (sporządzane z glinokrzemianów wapnia) – ok. 5 Å. Średnice porów w sitach 14X lub 15X są dwu-trzykrotnie większe, co umożliwia zatrzymywanie m.in. H2O, H2S, RSH (tiole), propanu, butanu. W praktyce są stosowane najczęściej jako środki osuszające.
-
Zdjęcie mikroskopowe zeolitu A
-
Luka oktaedryczna i tetraedryczna w sieci regularnej ściennie centrowanej
-
Struktura zeolitu A z rozwiniętą „powierzchnią wewnętrzną”
Urządzenia techniczne
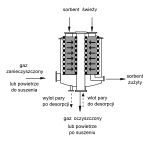
[edytuj]Adsorpcję prowadzi się w urządzeniach z adsorbentem nieruchomym, złożem ruchomym lub fluidalnym. Projektując urządzenia określa się typ i wymiary adsorbera, rodzaj i ilość sorbentu oraz czas przebywania gazu w złożu. Równocześnie ustala się sposób postępowania z sorbentem zużytym – nasyconym zanieczyszczeniami[11].
Sorbent może być:
- kierowany do regeneracji (termicznej, podciśnieniowej lub chemicznej, zob. np. system ADSOX, opisany w rozdz, Spalanie),
- likwidowany przez spalenie lub składowanie.
W wypadkach dezodoryzacji powietrza wnętrz korzyści związane z regeneracją sorbentu są zwykle mniejsze od zagrożeń, związanych z możliwością wtórnej emisji odorantów.
-
Budowa filtru pochłaniacza osobistej ochrony dróg oddechowych
-
Samochodowe filtry kabinowe
-
Wkład sorpcyjny filtru kabinowego
O kosztach stosowania filtrów węglowych do dezodoryzacji powietrza wnętrz decyduje tzw. pojemność adsorpcyjna poszczególnych sorbentów względem różnych związków lub mieszanin (czas pracy wkładów do przebicia złoża i niezbędnej wymiany). W przypadku węgla aktywnego stosuje się klasyfikację[10]:
- klasa 1 – pochłaniacz nieskuteczny,
- klasa 2 – mała pojemność sorpcyjna (wykorzystanie pochłaniaczy celowe tylko w specjalnie dobranych warunkach),
- klasa 3 – pojemność zadowalająca; możliwość zaadsorbowania ilości odorantów, stanowiącej 10–25% masy węgla,
- klasa 4 – pojemność duża; możliwość zaadsorbowania ilości odorantów, stanowiącej 20–50% masy węgla.
W odniesieniu do węgla aktywnego z łupin orzecha kokosowego stwierdzono, że w poszczególnych klasach znajdują się np.:
- klasa 2 – aldehyd mrówkowy i octowy, aminy, amoniak,
- klasa 3 – siarkowodór, spaliny z silników Diesla, zapachy zwierzęce,
- klasa 4 – alkohol etylowy i butylowy, benzen, kwas masłowy i octowy, siarkowodór, środki dezynfekcyjne i kosmetyki, zapachy kuchenne i szpitalne.
Przypisanie odorantu o niskim progu węchowej wyczuwalności do klasy 4 oznacza, że jest możliwe długotrwałe użytkowanie filtru bez jego wymiany. Czas pracy można np. oszacować przyjmując, że:
- – przyczyną zapachowej uciążliwości jest jeden odorant – kwas masłowy o stężeniu ok. 1 μg/m³ i progu wyczuwalności
- ok. cth= 1 μg/m³ (stężenie zapachowe ok. 10 ouE/m³, zapach słaby, ale rozpoznawalny i uciążliwy),
- – pochłaniacz z węglem zawiera ok. 1 kg sorbentu,
- – przebicie złoża następuje po zaadsorbowaniu ok. 30% masy.
Z zaliczenia kwasu masłowego do klasy 4 wynika, że filtr może zatrzymać 0,3 kg kwasu, czyli oczyścić 3 · 105 mg/0,01 mg/m³ = 3 · 107 m³ powietrza. W przypadku wentylacji pomieszczenia z wydajnością 1000 m³/h (5 wymian na godzinę dla kubatury 200 m³) taka ilość powietrza przepływałaby przez filtr w czasie 3 · 104 godzin, czyli przez ok. 3 lata.
W instalacjach przemysłowych adsorpcję i regenerację prowadzi się[11]:
- cyklicznie, w układach dwóch lub więcej adsorberów (pracujących zamiennie),
- w sposób ciągły, w adsorberach ze złożem ruchomym lub fluidalnym (zamknięty obieg adsorbentu).
-
Adsorber pionowy.
Złoże węgla aktywnego znajduje się na warstwie koksu,leżącej na ruszcie. Górna powierzchnia złoża jest przykrywana obciążoną siatką. Sorbent jest okresowo regenerowany strumieniem pary wodnej. -
Adsorber poziomy.
Warstwa sorbentu ma zwykle ok. 1 m grubości. Średnica zbiorników wynosi ok. 2 m, a ich długość – ok. 9 m (lub więcej) -
Schemat adsorbera pierścieniowego
Sorbent jest umieszczony w perforowanym koszu, otaczającym centralny wylotowy kanał powietrza oczyszczonego (pełniący funkcję wlotu w etapie desorpcji zanieczyszczeń).
-
Schemat konstrukcji adsorbera półkowego.
Na kolejnych półkach znajduje się fluidalne złoże sorbentu, stopniowo przesypujące się w dół, w przeciwprądzie do gazu. Sorbent zużyty może być pneumatycznie przenoszony do instalacji desorpcji, po czym zawracany na szczyt adsorbera. -
Schemat układu dwóch aparatów, pracujących cyklicznie jako adsorber i desorber – przykład odzyskiwania rozpuszczalników.
Etapy: I – adsorpcja rozpuszczalników ze strumienia powietrza, II – odzyskiwanie rozpuszczalników z użyciem pary wodnej, III – suszenie sorbentu
Czy znasz odpowiedzi?
[edytuj]- Jakie są podstawowe założenia modelu adsorpcji według Langmuira?
| Odpowiedź |
|---|
| Cząsteczki adsorbowanych gazów zatrzymują się w miejscach aktywnych, wysycając lokalne siły wiążące (oddziaływanie ma mały zasięg). „Oddziaływania boczne” między cząsteczkami na powierzchni są zaniedbywane (liczba cząsteczek uwalnianych z powierzchni zajętej w jednostce czasu jest proporcjonalna do udziału tej powierzchni, a liczba cząsteczek osiadających – do udziału powierzchni wolnej i prężności sorbatu w fazie gazowej. W stanie równowagi liczby cząsteczek osiadających i uwalnianych z powierzchni są jednakowe. |
- Jakie są podstawowe założenia modelu BET?
| Odpowiedź |
|---|
| Model BET opisuje adsorpcję wielowarstwową. Pierwsza warstwa powstaje tak, jak w modelu Langmuira, a następne w sposób analogiczny, z tym że działają tu siły oddziaływań adsorbat-adsorbat (energia zbliżona do ciepła skraplania). Całkowitą ilość zaadsorbowanego związku (a) można wyrazić poprzez pojemność monowarstwy (am) i udziały powierzchni sorbentu pokrytej kompleksami pojedynczymi, podwójnymi, potrójnymi itd. |
- Jak otrzymuje się węgiel aktywny i z czym jest związana jego pojemność sorpcyjna?
| Odpowiedź |
|---|
| Proces karbonizacji takich naturalnych sproszkowanych materiałów, jak węgiel drzewny, kości, łupiny orzechów, pestki. Otrzymany węgiel jest aktywny dzięki obecności mikroporów (d < 1nm), mezoporów (d = 2–50 nm) i makroporów (d > 50nm), dzięki którym powierzchnia właściwa Cakt wynosi 400–900 m²/g. Aktywność otrzymywanego sorbentu zwiększa się wprowadzając do materiału organicznego przed karbonizacją dodatki chemiczne, np. chlorki metali (aktywacja chemiczna), lub poddając produkty karbonizacji]] działaniu reagentów gazowych, np. pary wodnej i dwutlenek węgla. |
- Co oznacza pojęcie „sorbenty węglowe”?
| Odpowiedź |
|---|
| „Sorbenty węglowe” otrzymuje się impregnując węgiel aktywny o dużej zawartości makroporów różnymi reagentami chemicznymi, takimi jak sole lub tlenki metali, jod, siarka. Sorbenty stosowane np. w pochłaniaczach par związków organicznych i gazów ulegających reakcjom katalitycznym są impregnowane tlenkami miedzi, chromu i srebra. |
- Co oznacza stwierdzenie, że węgiel aktywny należy do klasy 4 w przypadkach dezodoryzacji zapachów kuchennych?
| Odpowiedź |
|---|
| Oznacza, że przed przebiciem złoża może zaadsorbowć ilość odorantów, stanowiącą 20–50% masy węgla. |
Przypisy
- ↑ Stanisław Bursa: [17 Zjawiska powierzchniowe.Adsorpcja]. W: Stanisław Bursa: Chemia fizyczna. Wyd. 2. Warszawa: PWN, 1979, s. 538-550. ISBN 83-01-00152-6.
- ↑ P.W. Atkins: [28 Procesy zachodzące na powierzchni ciał stałych]. W: Chemia fizyczna. Warszawa: PWN, 2001, s. 826-832. ISBN 83-01-13502-6.
- ↑ Adam Bielański: [18 Zjawiska powierzchniowe]. W: Chemia fizyczna. Warszawa: PWN, 1980, s. 710-718.
- ↑ Adam W. Marczewski: A Practical Guide to Isotherms of Adsorption on Heterogeneous Surfaces. guide.adsorption.org.
- ↑ 5,0 5,1 5,2 5,3 Materiały dydaktyczne UCS ćwiczenie 1
- ↑ 6,0 6,1 6,2 Mścisław Paderewski: Izoterma adsorpcji BET. W: Adsorpcja i adsorbery. Szczecin: Wydawnictwo Politechniki Szczecińskiej, 1982, s. 50–60.
- ↑ 7,0 7,1 Piotr Pietrowski. Pochłaniacze BHP. „Bezpieczeństwo pracy”, s. 24–27, 2006 (pol.).
- ↑ Mścisław Paderewski: Adsorbenty. W: Adsorpcja i adsorbery. Szczecin: Wydawnictwo Politechniki Szczecińskiej, 1982, s. 9–39.
- ↑ Krystyna Ślebioda. Metodyka kontroli środków ochrony indywidualnej. Środki ochrony układu oddechowego. „Inspektor pracy”, s. 3–8, 2002 (pol.).
- ↑ 10,0 10,1 J.Kośmider, B.Mazur-Chrzanowska, B.Wyszyński: [11.3: Adsorpcja i adsorbery]. W: Odory. Warszawa: Wydawnictwo Naukowe PWN, 2002, s. 223–235. ISBN 978-83-01-14525-5. [dostęp 2012-03-03]. (pol.)
- ↑ 11,0 11,1 Jerzy Warych: [19 Adsorbery]. W: Jerzy Warych: Aparatura chemiczna i procesowa. Warszawa: Oficyna Wydawnicza Politechniki Warszawskiej, 1996, s. 281–292. ISBN 83-86569-88-3.

















![{\displaystyle \Theta _{n-BET}(x)=a/a_{m}={\frac {1}{1-x}}\left({\frac {Kx\left[1-(n+1)x^{n}+nx^{n+1}\right]}{1+(K-1)x-Kx^{n+1}}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d889617500dba473a776a497ebf21bd3b61d707f)