Chemia organiczna/Wybrane praktyczne aspekty chemii organicznej/Wielopierścieniowe węglowodory aromatyczne
| Wielopierścieniowe węglowodory aromatyczne (WWA) - związki organiczne, węglowodory aromatyczne zawierające skondensowane pierścienie aromatyczne bez podstawników. |
Wielopierścieniowe węglowodory aromatyczne są w warunkach normalnych bezbarwnymi, białymi lub bladożółtymi ciałami stałymi, nierozpuszczalnymi w wodzie. Są mało reaktywne chemicznie. Ulegają działaniu tlenu i innych utleniaczy. Pod wpływem promieniowania ultrafioletowego wykazują właściwości fluorescencyjne.
Aceny
[edytuj]| Aceny - związki organiczne, wielopierścieniowe węglowodory aromatyczne, w których cząsteczkach pierścienie są skondensowane liniowo. |
Nazwy acenów (oprócz naftalenu i antracenu) tworzy się przez dodanie do liczebnika określającego ilość pierścieni końcówki -cen.
Aceny tworzą szereg homologiczny, w którym każdy człon różni się od poprzedniego jednym pierścieniem aromatycznym.
| n | wzór acenu | nazwa związku |
|---|---|---|
| n | 
|
acen (wzór ogólny) |
| 0 | 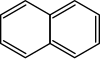
|
naftalen |
| 1 | antracen | |
| 2 | tetracen (naftacen) | |
| 3 | pentacen | |
| 4 | heksacen |
Naftalen to białe, krystaliczne ciało stałe. Ma charakterystyczny zapach smoły. W powietrzu spala się kopcącym płomieniem. Jest nierozpuszczalny w wodzie, rozpuszcza się natomiast w rozpuszczalnikach organicznych. Naftalen ulega reakcjom: nitrowania, sulfonowania, uwodornienia oraz chlorowcowania.
Jest stosowany w produkcji tworzyw sztucznych, insektycydów, barwników. Jest również popularnym środkiem przeciw molom.
Antracen
[edytuj]Antracen jest drugim przedstawicielem szeregu homologicznego acenów. Jest zółtawym ciałem stałym, ciemniejącym pod wpływem światła. Nie rozpuszcza się w wodzie, rozpuszcza się w eterze dietylowym, alkoholu etylowym, benzenie i heksanie. Pod wpływem promieniowania ultrafioletowego wykazuje właściwości fluorescencyjne.

Antracen ulega również reakcji dimeryzacji.
Antracen ulega utlenieniu do antrachinonu:

Jest stosowany do produkcji lakierów oraz związków używanych w procesie konserwacji drewna.
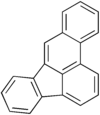
Fenantren
[edytuj]Fenantren to trójczłonowy węglowodór aromatyczny, będący izomerem antracenu. W warunkach normalnych jest bezbarwnym ciałem stałym, w postaci drobnych, połyskujących płytek.

Fenantren jest stosowany w produkcji barwników, materiałów wybuchowych oraz w farmacji. Pierścienie fenantrenu i antracenu występują w wielu związkach o znaczeniu biologicznym, jak hormony, alkaloidy, witaminy, na przykład:
| Ryboflawina (witamina B2) | Morfina | Kodeina | Tebaina | Heroina |
|---|---|---|---|---|
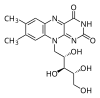
|
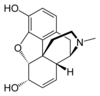
|

|

|

|
Piren
[edytuj]Piren zawiera cztery pierścienie aromatyczne. Jest to bezbarwne, krystaliczne ciało stałe, rozpuszczalne w eterze dimetylowym i alkoholu etylowym. Jego roztwory wykazują właściwości fluorescencyjne. W kryształach i niektórych roztworach tworzy dimery.

Jest szeroko stosowany jako składnik pigmentów oraz pestycydów. Jest też środkiem plastyfikującym tworzywa sztuczne.
Benzopireny
[edytuj]Benzopireny są grupą węglowodorów aromatycznych o pięciu pierścieniach w cząsteczce. Posiadają kilka izomerów, w zależności od miejsca przyłączenia pierścienia benzenowego do cząsteczki pirenu. Nie rozpuszczają się one w wodzie, rozpuszczalne są natomiast w rozpuszczalnikach organicznych.
| Benzo[a]piren | Benzo[e]piren |
|---|---|

|

|
Źródła WWA w środowisku
[edytuj]Wielopierścieniowe węglowodory aromatyczne mogą pochodzić ze źródeł naturalnych lub antropogennych. Do źródeł naturalnych zaliczamy:
- naturalne procesy powstawania ropy naftowej, łupków bitumicznych, węgla
- działalność wulkaniczna
- pożary lasów i łąk
- synteza przez glony morskie
- biosynteza przez mikroorganizmy
Źródła antropogeniczne WWA to przede wszystkim:
- produkty niepełnego spalania paliw kopalnych i drewna, zwłaszcza w źle regulowanych, starszych piecach węglowych
- lotne pyły i popioły - produkty spalania paliw i utylizacji śmieci
- koksownie, rafinerie, huty żelaza, aluminium i miedzi
- produkcja smoły, kreozotu i węgla drzewnego
WWA występują w powietrzu w postaci stałej, na powierzchni cząstek pyłów, mgły i dymów, wraz z którymi opadają na glebę, rośliny i wody powierzchniowe. Węglowodory te nie mogą tworzyć samoistnie cząstek stałych. Stężenie WWA w powietrzu zależy od:
- odległości od źródła emisji
- wysokości punktu emisji
- warunków meteorologicznych (głównie od wiatru)
- pory roku
Największa ilość WWA jest zgromadzona w glebie, gdyż opada na nią większość zanieczyszczeń. Źródłami zanieczyszczenia gleby przez WWA są:
- wymywanie WWA z powierzchni dróg
- przenikanie ze ścieków przemysłowych, składowisk odpadów odlewniczych i materiałów budowlanych
- nieoczyszczone ścieki bytowo-gospodarcze
Do wody WWA przedostają się ze ścieków przemysłowych, zwłaszcza koksowniczych, hutniczych, gazowniczych i rafineryjnych. Są także wymywane z gleby i nawierzchni dróg. Opadają również wraz z deszczem. Wskutek zwiększonej ilości detergentów w wodach powierzchniowych i płynących, zwiększa się zawartość w tych wodach WWA, których rozpuszczalność poprawia się właśnie dzięki działaniu detergentów. Wielopierścieniowe węglowodory aromatyczne są też wymywane z antykorozyjnych powłok ochronnych rur wodociągowych. Woda zanieczyszczona WWA oraz pochodzącymi z tego samego źródła chlorkiem winylu, arsenem i azbestem, powoduje raka skóry, wątroby czy przewodu pokarmowego.
Ze względu na swą niską rozpuszczalność, WWA przedostają się do osadów dennych w zbiornikach wodnych, gdzie są rozkładane i unieczynniane przez mikroorganizmy, co częściowo zmniejsza ich zawartość w wodach powierzchniowych.
Występowanie WWA w żywności
[edytuj]Znaczne ilości WWA znajdują się na skórkach owoców. Ponadto zawarte w roślinach lignina, skrobia, cukry proste, aminokwasy, kwasy tłuszczowe czy β-karoten w wysokich temperaturach przechodzą w WWA. Oprócz tego znaczące ilości trujących węglowodorów są zawarte w mięsie, które zawierają ponadto prekancerogenne azotyny, dodawane jako substancje konserwujące. Mogą one nasilać działanie rakotwórcze. Największe ilości WWA zawierają mięsa tłuste, w tym wieprzowina.
Również kawa naturalna, kawa zbożowa i kakao zawierają WWA, co wiąże się z użyciem wysokich temperatur w procesach ich otrzymywania. Zanieczyszczone WWA mogą być również oleje rzepakowe. Toksyczne związki mogą pochodzić zarówno z gleby, na której były uprawiane rośliny, jak i z dymu, którym suszy się materiał roślinny lub z rozpuszczalnika używanego w procesie ekstrakcji.
WWA w tytoniu
[edytuj]Wśród ponad 3 tysięcy związków, będących produktami pirolizy tytoniu i bibułki w temperaturze 600 - 1000 °C stwierdzono obecność około 150 różnych WWA, w tym benzo[a]pirenu i dibenzo[a,h]antracenu. Obecne są również karcerogenne nitrozoaminy, a także katechole, wzmacniające działanie WWA. Uciążliwym czynnikiem jest kumulowanie się dymu tytoniowego w zamkniętych pomieszczeniach. Dlatego też na działanie toksycznych substancji narażeni są nie tylko sami palacze, ale również palacze bierni.
Unieszkodliwianie WWA w środowisku
[edytuj]Biodegradacja
[edytuj]Biodegradacja WWA zachodzi głównie w glebie i w wodzie. Niektóre mikroorganizmy wyspecjalizowały się w rozkładzie tych związków. WWA są jednym ze źródeł węgla, potrzebnego bakteriom do procesów metabolicznych. Najłatwiej rozkładane są węglowodory dwu- i trójpierścieniowe. Węglowodory czteropierścieniowe są rozkładane na zasadzie kometabolizmu (tzn. mikroorganizm pobiera węgiel również z innych źródeł). Bakterie rozkładające węglowodory aromatyczne występują najczęściej w miejscach wyjątkowo dużej emisji WWA. Toksyczne węglowodory są rozkładane również przez grzyby.
Na biodegradację WWA niekorzystnie wpływa obecność innych zanieczyszczeń, na przykład detergentów, które niszczą błony komórkowe bakterii. Inną grupą toksyn są herbicydy, które hamują metabolizm fenantrenu.
Efektywność biodegradacji zwiększa się przez sztuczną adaptację i selekcję mikroorganizmów lub zwiększanie dopływu tlenu.
Przemiany abiotyczne
[edytuj]Transformacja abiotyczna WWA zachodzi głównie w atmosferze. Węglowodory aromatyczne ulegają fotoutlenianiu oraz reagują z tlenkami azotu lub z ozonem. Fotoutlenianie prowadzi do utlenionych form węglowodorów, głównie chinonów, które są jeszcze bardziej toksyczne. Reakcja taka zachodzi łatwo dzięki zdolności WWA do adsorpcji promieni UV. Ozon utlenia WWA do chinonów i kwasów karboksylowych. Węglowodory o większej liczbie pierścieni reagują z tlenkami azotu, tworząc pochodne nitrowe o właściwościach mutagennych i kancerogennych. Na przykład nieaktywny biologicznie piren reaguje z utworzeniem silnie toksycznego 3-nitropirenu. Równie groźny jest 1-nitropiren, ulegający przemianom do innych pochodnych (zobacz www.intox.org). Pochodne nitrowe mogą być redukowane do jeszcze bardziej toksycznych amin.

WWA obecne w wodach powierzchniowych ulegają fotoutlenianiu do chinonów, fenoli i dioli. Może również dochodzić do rozpadu pierścieni aromatycznych.
Toksyczność WWA
[edytuj]Historia badań nad toksycznością WWA
[edytuj]W 1775 roku Percival Pott, chirurg angielski, zaobserwował, że u kominiarzy, których znaczną część stanowiły kilkuletnie dzieci, występują dosyć często rak moszny oraz nowotwory skóry, co uczony połączył z narażeniem na działanie sadzy. W 1875 badania Anglika zostały potwierdzone przez Richarda von Volkmanna, który wskazał również na występowanie raka skóry u smolarzy. Korzystając z prac obu uczonych, w roku 1915 Japończycy: Koichi Ichikawie oraz Katsusaburo Yamagiwie rozpoczęli badania nad toksycznością WWA. Po wielu latach udało im się wywołać zachorowania na nowotwory skóry u zwierząt pod wpływem smoły.
W roku 1947 sir Ernest Kenneway dowiódł związku pomiędzy pracą przy produkcji smoły węglowej a zachorowalnością na raka płuc u robotników. Jego prace poszerzył sir Richard Doll. Na przestrzeni dwudziestego wieku udowodniono, że za zaobserwowane zmiany nowotworowe są odpowiedzialne zawarte w smole oraz w sadzy WWA.
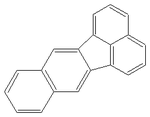
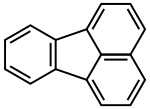
Międzynarodowa Agencja Badania Raka w roku 1983 uznała za najbardziej toksyczne policykliczne węglowodory aromatyczne poniższe sześć związków:

|
|
|
| benzo[a]piren | benzo[b]fluoranten | benzo[k]fluoranten |
|

|

|
| fluoranten | indeno[1,2,3-c,d]piren | benzo[g,h,i]perylen |
Toksokinetyka WWA
[edytuj]

WWA mogą się dostawać do organizmu przez układ oddechowy, układ pokarmowy lub przez skórę. W postaci par lub pyłów mogą się osadzać w drogach oddechowych, skąd za pomocą transportu rzęskowo - śluzowego przedostają się do płuc lub układu pokarmowego, gdzie trafiają również ze spożywaną żywnością lub przyjmowaną wodą. Przez skórę węglowodory te przenikają w wypadku bezpośredniego kontaktu.
Po dostaniu się do organizmu, WWA są przenoszone wraz z krwią do tkanek. Będąc dobrze rozpuszczalnymi w tłuszczach, łatwo przenikają przez lipidowo - białkowe błony komórkowe dzięki dyfuzji. Wewnątrz komórki węglowodory przechodzą w czynne chemicznie związki, które łączą się z cząsteczkami DNA, RNA i białek poprzez wiązania kowalencyjne. Następnie powstałe przejściowe metabolity przechodzą reakcje sprzęgania ze związkami endogennymi, takimi jak kwas siarkowy, kwas glukoronowy czy glutation.
Benzo[a]piren podczas procesu metabolizy tworzy liczne związki przejściowe: tlenki arenowe, fenole, chinony, dihydrodiole, fenolodiole. Jednym z tych związków jest 9,10-epoksy-7,8-dihydroksybenzo[a]piren, który posiada cztery optycznie czynne izomery, z których (+)-(7R,8S,9S,10R)-9,10-epoksy-7,8-dihydroksybenzo[a]piren jest głównym metabolitem. Metabolizm pirenu prowadzi natomiast do pochodnych hydroksylowych oraz do chinonów.
WWA są wydalane z organizmu, niezależnie od drogi podania, wraz z żółcią i (w mniejszym stopniu) z moczem.
Mechanizm działania toksycznego
[edytuj]W metabolizmie WWA jako metabolity powstają najczęściej epoksydy, które są aktywnymi substancjami rakotwórczymi. Znaczna ich część jest unieczynniana przez odpowiednie enzymy i wydalana z ustroju, jednak część epoksydów, zwłaszcza epoksydiole, zachowuje zdolność do tworzenia wiązań kowalencyjnych z cząsteczkami DNA i RNA. Powoduje to zmiany nowotworowe w komórkach organizmu. Obserwuje się zmniejszanie lub zwiększanie działania rakotwórczego mieszanin WWA wobec pojedynczych ich składników.
Teratogenność WWA
[edytuj]WWA działają szkodliwie na jądra, a zwłaszcza na procesy nasieniotwórcze. Metabolity benzo[a]pirenu wiążą się z białkami struktur kanalików nasiennych jąder, zaburzają replikację DNA i zaburzają spermatogenezę. Oprócz groźnych mutacji DNA efektem ekspozycji na WWA są obniżenie ruchliwości plemników, zwiększona liczba komórek nieprawidłowych oraz obniżenie ilości produkowanego nasienia i zdolności do penetracji i zapłodnienia komórki jajowej. W komórkach jajowych stwierdzono natomiast anomalię polegającą na diploidalności chromosomów.
Podczas badań labolatoryjnych WWA powodowały ponadto wady w budowie serca i powłok brzusznych u zarodków kurzych oraz zmniejszenie masy ciała płodów szczurzych.
Cytotoksyczność WWA
[edytuj]| Cytotoksyczność - toksyczność substancji względem komórek danego organizmu. |
Powstające w czasie metabolizmu WWA utlenione formy węglowodorów pierścieniowych, wraz z produktami częściowego utleniania tłuszczów, wywierają działanie mutagenne oraz powodują zaburzenia stabilności błon komórkowych. Podczas badań na myszach obserwowano uszkodzenie komórek nerek, wątroby, śledziony i grasicy.
Immunotoksyczność
[edytuj]Po ekspozycji dorosłych osobników zwierząt laboratoryjnych na WWA obserwowano:
- zmiany w narządach układu odpornościowego (szpik kostny, grasica, śledziona, węzły chłonne)
- zmiany w poziomie immunoglobulin
- zmniejszenie ilości komórek NK w śledzionie
- nieprawidłową syntezę cytokin w śledzionie
- zaburzenia w aktywacji limfocytów poprzez wzrost wewnątrzkomórkowego stężenia Ca2+ w limfocytach
Indukcja enzymatyczna
[edytuj]| Indukcja enzymatyczna - wzrost aktywności enzymu pod wpływem induktora, cząsteczki pochodzącej z metabolizmu komórki lub z zewnątrz. |
WWA przyspieszają działanie enzymów odpowiedzialnych za przyspieszenie metabolizmu leków, a przez to skracanie czasu ich działania na organizm. Są to tak ważne leki, jak barbiturany, neuroleptyki, leki przeciwdepresyjne i przeciwzakrzepowe. Dlatego podczas kuracji należy zaprzestać palenia papierosów i spożywania wędzonego mięsa.
Działanie WWA na rośliny i zwierzęta
[edytuj]U glonów, roślin wodnych i organizmów bezkręgowych, jak małże, skorupiaki, mięczaki, dochodzi do silnej akumulacji WWA. Organizmy te, będące w zbiornikach wodnych producentami i konsumentami I rzędu, nie wytwarzają enzymów unieczynniających te trucizny. W związku z tym WWA są przenoszone do wyższych poziomów troficznych, a w konsekwencji mogą trafiać do organizmu człowieka. Stwierdzono również, że WWA działają toksycznie wobec mikroflory bakteryjnej ekosystemów i stanowią zagrożenie dla ich równowagi.
U zwierząt w wyniku kontaktu z WWA może dojść do martwicy niektórych narządów lub ich uszkodzenia. Dotyczy to zwłaszcza organów układów: chłonnego, krwiotwórczego (zwłaszcza szpik kostny) i oddechowego. Substancje te działają również szkodliwie na jądra samców oraz na wątrobę.
Ograniczenie ekspozycji indywidualnej
[edytuj]Ekspozycję indywidualną na działanie WWA można ograniczyć poprzez:
- unikanie spożywania mięs wędzonych i smażonych oraz grillowanego mięsa
- unikanie smażenia żywności
- obieranie ze skórek warzyw i owoców, zwłaszcza tych, które rosły blisko dróg i zakładów przemysłowych
- dokładne mycie warzyw i owoców
- eliminacja z diety kawy parzonej i co najmniej częściowa eliminacja kakao
Źródła
[edytuj]- Artykuł na polskiej Wikipedii
- Wielopierścieniowe węglowodory aromatyczne (plik PDF)
- Mgr farm. Maciej Bilek: WWA-Wielopierścieniowe węglowodory aromatyczne (plik Microsoft Word)



